
Les rétrovirus sont des virus ARN avec une biogénèse et une multiplication intracellulaire qui conduit à la libération des virus par bourgeonnement à la surface de la cellule. Nous étudions deux rétrovirus: un onco-rétrovirus, le virus de la leucémie murine (MLV), qui s’est révélé inestimable pour notre compréhension des processus cellulaires de base (découverte d’oncogènes, expression génétique eucaryote, pathologie virale et essais de thérapie génique avec des vecteurs rétroviraux) et le virus de l’immunodéficience humaine du type 1 (VIH-1) qui est l’agent causal de l’épidémie mondiale de SIDA. Bien que les deux virus aient des capacités codantes différentes, ils partagent un cycle de réplication similaire dans les cellules en culture.
VIH-1 MLV
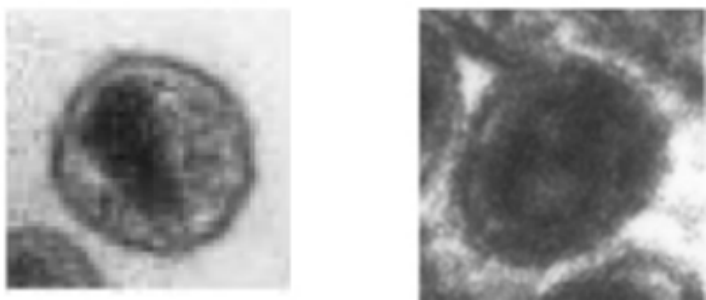
Clichés de microscopie électronique de virus libérés dans le milieu de cellules infectées en culture
Tous les rétrovirus renferment un génome ARN dimérique formé de deux monomères identiques. Après infection, cet ARN est rétro transcrit en copie ADN qui va s’intégrer dans les chromosomes de l’hôte et pérenniser l’infection. Nous sommes intéressés par les étapes tardives de la réplication rétrovirale qui commencent par la transcription de cette copie ADN intégrée. Après la transcription, seule une partie des transcrits primaires est épissée pour produire des ARNm codant les protéines d’enveloppe, les protéines accessoires et régulatrices du virus. L’autre partie des transcrits échappe à l’épissage et sort du noyau en dépit de la persistance d’introns. Cet export atypique d’ARN non maturé reste obscur, en particulier pour MLV. Une fois dans le cytoplasme, cet ARN non-épissé a plusieurs destinées. Il est capturé par la machine de traduction pour la synthèse des protéines structurales (Gag) et enzymatiques (GagPol) mais il peut aussi être acheminé à la membrane plasmique pour être encapsidé sous forme dimérique dans les virions en formation.
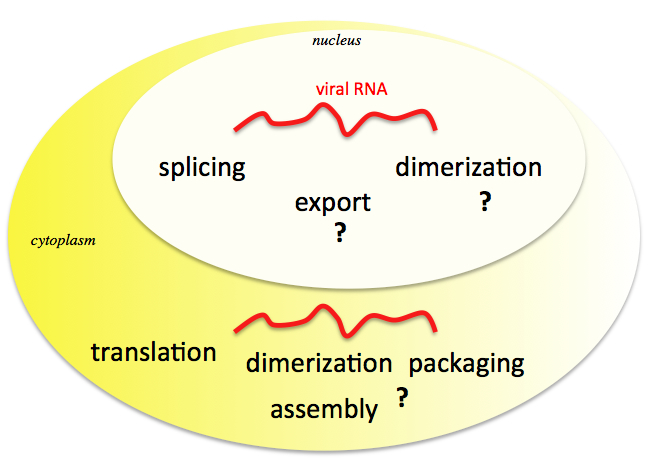
Différentes destinées de l’ARN rétroviral dans la cellule hôte
Ce métabolisme très particulier de l’ARN viral, crucial pour l’infectiosité du virus, comprend encore de nombreuses zones d’ombres. Comment se fait l’équilibre dans le noyau entre l’export et l’épissage des transcrits primaires et dans le cytoplasme comment est régulé l’équilibre entre la traduction et l’encapsidation de l’ARN. Comment l’ARN viral qui est largement minoritaire dans la cellule est sélectionné parmi les nombreux autres ARNs cellulaires et viraux. On sait que la polyprotéine Gag est un partenaire intime de l’ARN viral lors des phases tardives. Nous étudions comment Gag contribue à la dimérisation et l’encapsidation de l’ARN et comment les composants viraux Gag, GagPol et l’ARN atteignent les sites d’assemblage du virus à la surface de la cellule ? L’équipe s’intéresse aux mécanismes moléculaires et structuraux ainsi qu’aux aspects de biologie cellulaire impliqués dans le métabolisme de l’ARN viral. Depuis quelques années, nos efforts portent sur l’aspect dynamique de ces mécanismes (Fig ci-dessous). Pour cela, nous développons des approches innovantes et très performantes pour conduire nos investigations en temps réel, dans les cellules vivantes, à l’échelle de la cellule individuelle et de la molécule unique d’ARN. Nous espérons que l’étude des mécanismes moléculaires de la biogénèse et de la réplication virale aidera à lutter contre les maladies induites par les rétrovirus, y compris le SIDA et le cancer.
Vidéo réalisée en microscopie TIRF montrant la formation de particules VIH-1 fluorescentes (points blancs) à la surface des cellules hôtes. Les productions virales sont très différentes parmi les quatre cellules observées.
En bref
Organisme(s) modèle(s)
VIH-1, MLV
Processus biologique étudié
Biogénèse des particules virales et encapsidation des ARN viraux
Techniques utilisées
- Microscopie de fluorescence (TIRF, super-résolution)
- Imagerie ARN (molécule unique) (3D-SIM)
- RT-qPCR
- Microfluidique
Financements













