L’équipe évolue en 2024. Notre site web va être mis à jour très prochainement (on l’espère).
Les principaux mots clés de l’équipe sont : virologie, neurobiologie, plasticité synaptique, trafic intracellulaire, neurodégénération, imagerie en temps réel, intelligence artificielle (machine learning), antiviraux, sécrétion, vésicules extracellulaires, … Les virus qu’on aiment particulièrement en ce moment : Coronavirus, Flavivirus, Bunyavirus, virus de l’Hépatite B, VIH, …
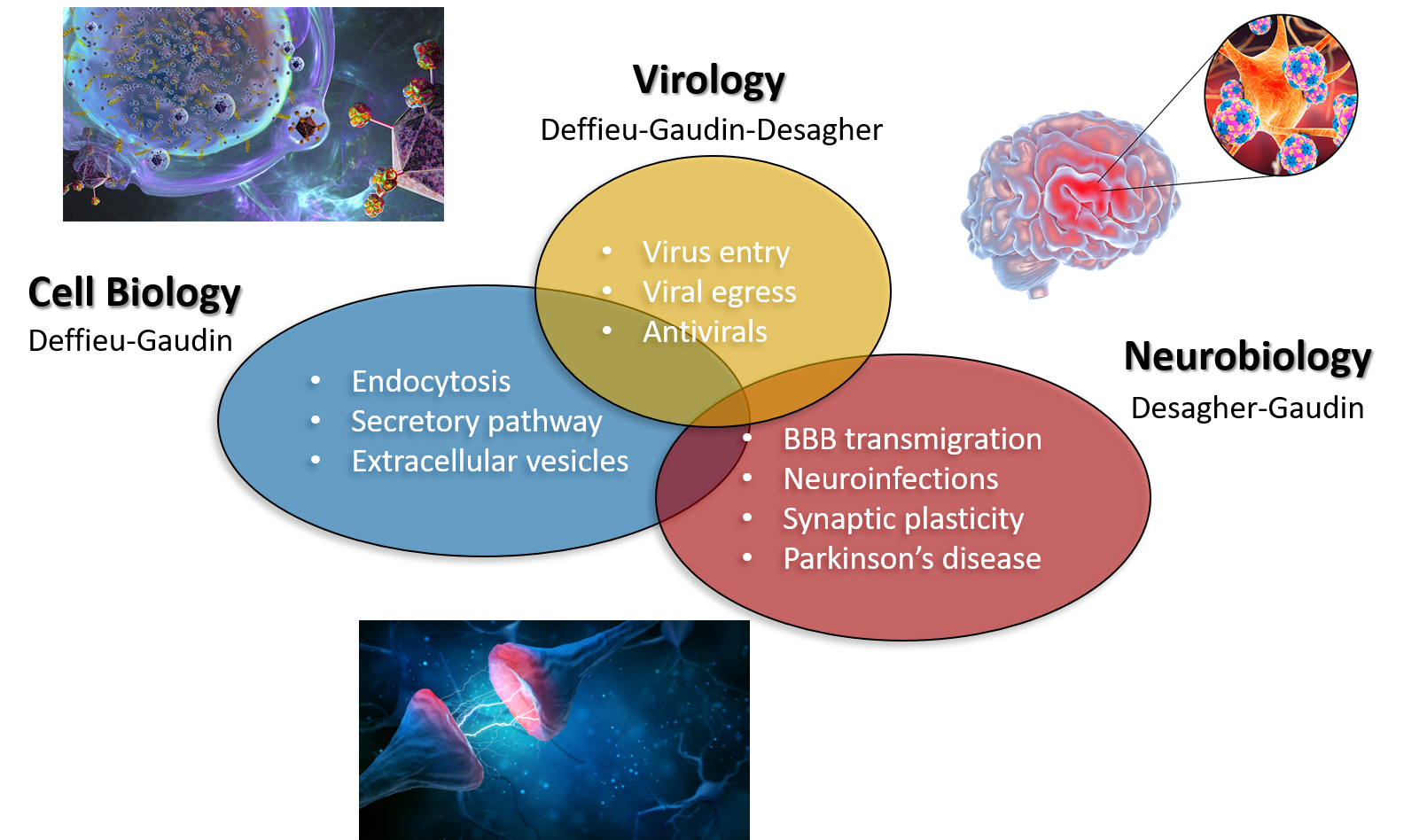
Les membres de l’équipe travaillent ensemble dans des thématiques interdisciplinaires afin de répondre à des questions majeures associées à la virologie, biologie cellulaire et neurobiologie.
Plasmides de l’équipe disponible sur :
Notre équipe “Dynamique Membranaire & Virus” (MDV) a pour but d’étudier les interactions entre virus et cellules à différentes échelles spatiotemporelles. Les virus étudiés dans le laboratoire nous permettent de mieux comprendre des mécanismes moléculaires et cellulaires fondamentaux et réciproquement, la biologie cellulaire des infections virales nous donne des informations précieuses quant aux processus de subversion virale. Spécifiquement, nos projets s’articulent autour de 3 axes complémentaires :
- Transport intracellulaire entrant/sortant : comment les virus interagissent avec leurs récepteurs à la surface de la cellule et dans les endosomes lors des étapes d’entrée ? Comment la cellule régule la sécrétion de vésicules extracellulaires et de récepteur viraux transmembranaires néo-synthétisés ? Nos virus modèles pour ses études sont l’hépatite B, l’hépatite C et SARS-CoV-2.
- Quelles stratégies de dissémination dans le cerveau utilisent-ils et quel en est l’impact ? Comment les virus traversent la barrière hématoencéphalique pour atteindre le système nerveux central ? Quel est l’impact de l’exposition du cerveau aux virus (Flavivirus, Coronavirus, Bunyavirus, HIV, …)
- Développement de nouvelles molécules antivirales à large spectre. Comment améliorer leur efficacité, stabilité, solubilité, biodisponibilité ? Quel est le mode d’action et la cible des antiviraux dévelopés ?
Dans l’axe I, nous avons identifié que la DNAseI est encapsidée lors de l’assemblage du virus de l’hépatite B (Hallez et al., Nature Microbiol, 2019) et imagé en temps réel l’association Core-DNAseI. Récemment, nous avons décrit la dynamique des interactions entre le virus de l’hépatite C et son récepteur cellulaire : l’Occludine (Deffieu, Clément et al, Hepatol, 2022). Surprenamment, nous avons découvert que ces interactions n’avaient pas lieu aux jonctions serrées, la localisation habituelles de l’Occludine. En effet, les particules virales accumulent l’Occludine en dehors de ces jonction (Figure 1), ce qui les stabilise et favorise leur internalisation. Nous développons des approches similaires pour d’autres virus enveloppés.
Figure 1. Suivi en temps réel des interactions entre le virus de l’hépatite C (Magenta) et son récepteur cellulaire : l’Occludin (cyan). D’après Deffieu et al, Hepatology, 2022.
Dans l’axe II, nous avons mis en évidence que les virus Zika et VIH augmentent la transmigration des monocytes au travers de la barrière hémato-encéphalique in vitro et in vivo. Nos résultats renforcent l’hypothèse du « cheval de Troie » (Figure 2 and Ayala-Nunez et al, Nature Comm, 2019). Le cerveau étant un réservoir important du VIH, nous étudions actuellement les mécanismes moléculaires favorisant l’invasion du système nerveux central par le VIH.
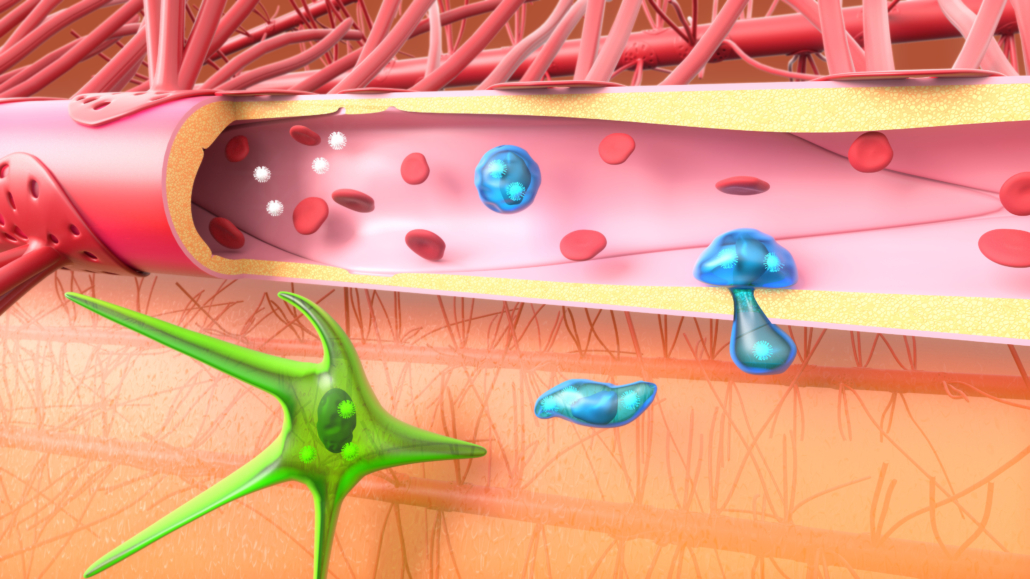
Figure 2. Des particules virales dans la circulation sanguine infectent (ou sont capturées par) des cellules du sang qui vont alors transmigrer au travers de l’endothélium, permettant au virus de passer cette barrière imperméable.
Nous manipulons couramment dans le laboratoire les techniques de virologies relatives aux virus VHB, VHC, Zika, VIH et SARS-CoV-2. Cela inclus : RT-qPCR, Western Blot, cytométrie en flux, immunofluorescence, ARN interférence, plaque assay, … Nous avons également développé des approches innovantes avancées, notamment les méthodes CRISPR/Cas9, RUSH, imagerie confocale 3D à haute résolution sur cellules vivantes, spectrométrie de masse, système xénotypique sur embryon de poisson zèbre (en collaboration), explants humains, organoides cérébraux dérivés de cellules souches, … Nous avons récemment implémenté la culture d’organoides cerébraux à partir de cellules souches (Figure 3) pour étudier la dissémination de virus neurotropes et leur impacte sur les fonctions neuronales.
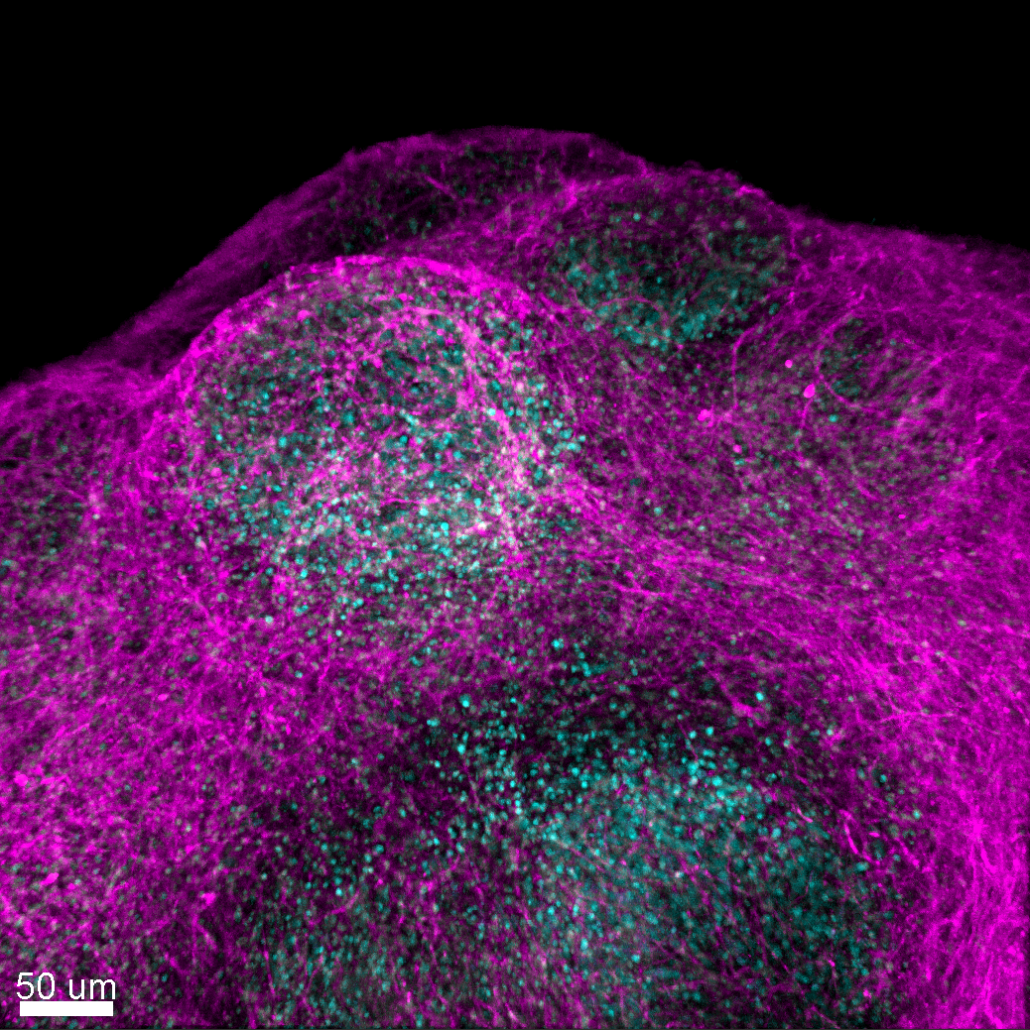
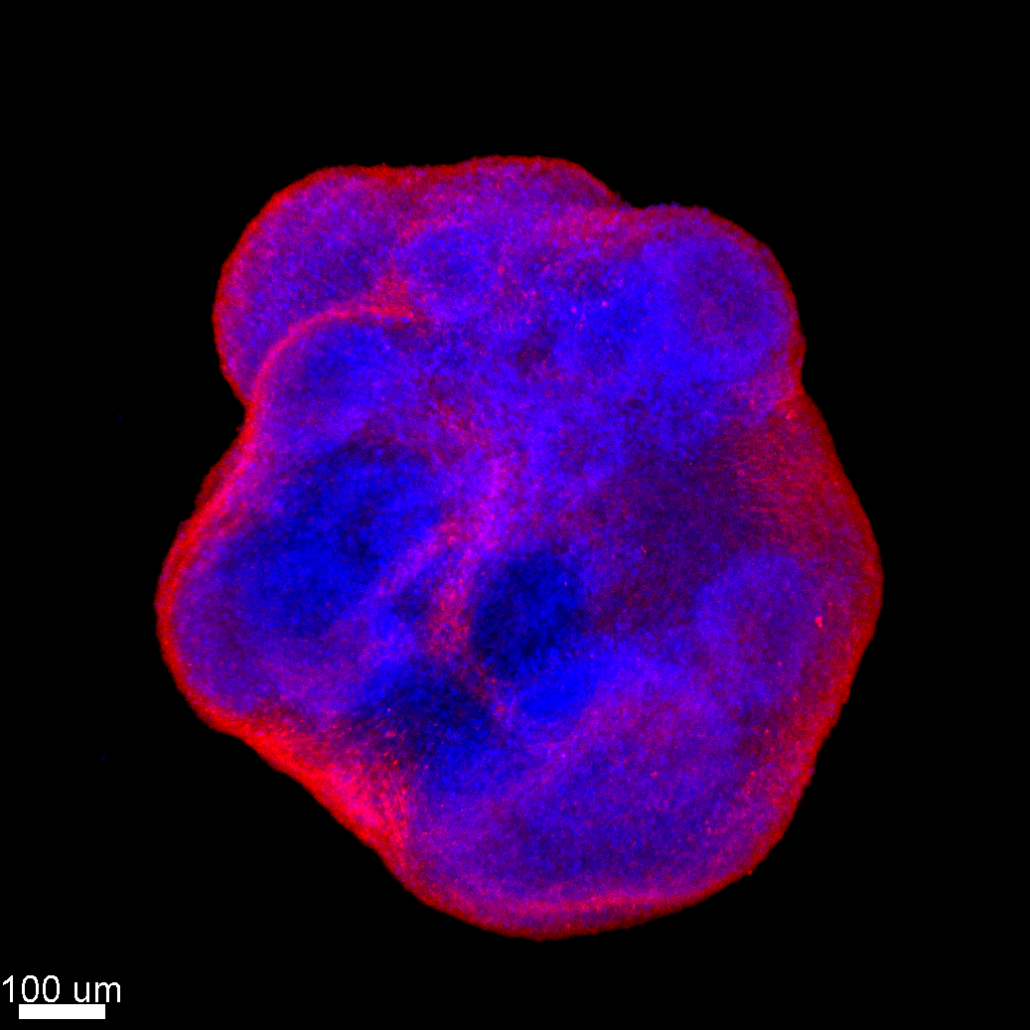
Figure 3. Imagerie confocale d’organoides cérébraux
La philosophie du laboratoire est de dépasser les limites méthodologiques, ne pas se dire « ce n’est pas possible », mais plutôt « comment va-t-on y arriver ? » pour aller au-delà des dogmes conceptuels et autres idées reçues.
L’équipe est affiliée à la Société de Biologie Cellulaire de France (SBCF) et R.Gaudin fait parti des membres élus du conseil de la SBCF depuis 2016.

R.Gaudin a été nominé en tant que « Full member » de la World Society for Virology (WSV) en 2019.

De plus, dans le cadre du projet Salicov, en collaboration avec l’AP-HP de Paris, nous étudions l’impacte de la salive sur l’infectivité des virus respiratoires. Une notice d’information sur le traitement des données des patients ayant fait don de leur salive à la recherche ans le cadre de ce projet est disponible ici.
Ils nous soutiennent (ou nous ont soutenu)
- ANR
- ANRS
- Sidaction
- CNRS-INSB
- SATT AxlR
- La Région Occitanie
- Labex NUMEV
- Atip-Avenir
- FRM
- EMBO LTF
- INSERM-région
- Chaire d’attractivité Idex (Université de Strasbourg)
- Prestige (Européen)
- Programme Stefanik (Ambassade Franco-Slovaque)
- Initiation de collaboration avec la Chine (Ambassade Franco-Chinoise)
En bref
L’équipe MDV étudie ce que font les virus aux cellules … Ou plutôt ce que font les cellules aux virus… Brefs la vie intime des relations virus-cellules
Financements