 L’équipe AMI étudie les interactions entre les agents pathogènes (bactéries et virus) et le mécanisme d’autophagie, notamment l’autophagie canonique et l’Atg8ylation, tout au long du cycle de vie de l’agent pathogène, de son entrée dans les cellules cibles à sa réplication et à son homéostasie cellulaire. Ce projet, qui s’appuie sur des aspects fondamentaux des interactions entre les processus liés à l’autophagie et les agents pathogènes, permettra de mieux comprendre les mécanismes des infections.
L’équipe AMI étudie les interactions entre les agents pathogènes (bactéries et virus) et le mécanisme d’autophagie, notamment l’autophagie canonique et l’Atg8ylation, tout au long du cycle de vie de l’agent pathogène, de son entrée dans les cellules cibles à sa réplication et à son homéostasie cellulaire. Ce projet, qui s’appuie sur des aspects fondamentaux des interactions entre les processus liés à l’autophagie et les agents pathogènes, permettra de mieux comprendre les mécanismes des infections.  L’équipe AMI en Mai 2025, de gauche à droite : Nathalie Chazal, Guilhem Cantaloube, Lucas Boulet, Romane Deteve, Sébastien Lainé, Marie Villares, Jerôme Feuillard, Julie Couston, Fiona Nicole, Mickaël Blaise, Coralie Daussy, Célia Chamontin, Marylène Mougel, Lucile Espert.
L’équipe AMI en Mai 2025, de gauche à droite : Nathalie Chazal, Guilhem Cantaloube, Lucas Boulet, Romane Deteve, Sébastien Lainé, Marie Villares, Jerôme Feuillard, Julie Couston, Fiona Nicole, Mickaël Blaise, Coralie Daussy, Célia Chamontin, Marylène Mougel, Lucile Espert.
Notre équipe étudie les interactions entre les agents pathogènes (virus et bactéries) et la réponse cellulaire de l’hôte, tout au long du cycle de vie du pathogène. En particulier, nous étudions le rôle des mécanismes d’autophagie et, plus généralement, d’atg8ylation, au cours des infections. Nos projets s’appuient sur des aspects fondamentaux permettant de mieux comprendre les mécanismes liés aux infections afin de permettre l’identification de cibles pour le développement d’approches translationnelles susceptibles de déboucher sur de nouvelles stratégies anti-infectieuses.
Nos projets se décline en 3 axes majoritaires :
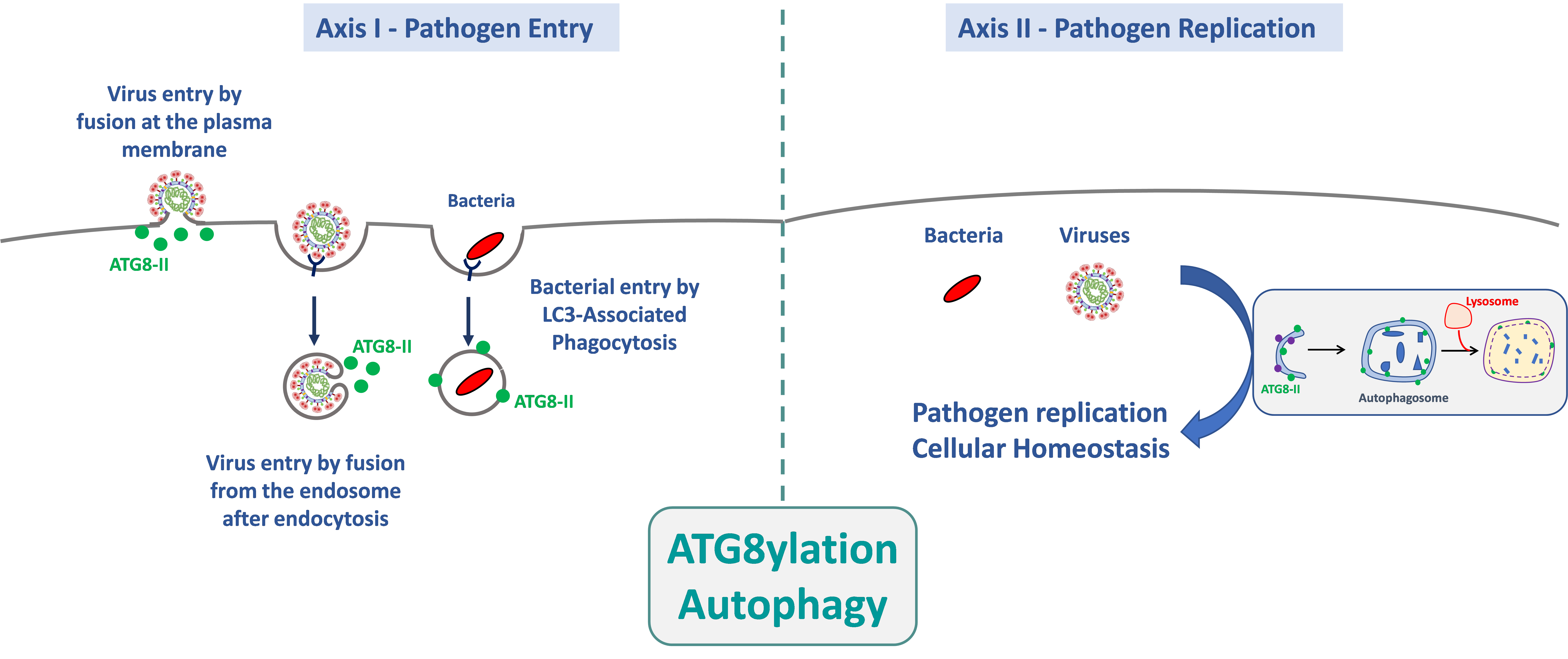
1. Rôle de l’autophagie et de l’atg8ylation dans l’entrée des agents pathogènes dans leurs cellules cibles.
L’entrée d’un agent pathogène est, par définition, le premier événement du cycle microbien qui déclenche une réponse cellulaire. Cette dernière peut radicalement modifier l’issue de l’infection car, pendant et peu après l’entrée, les agents pathogènes n’expriment pas encore leur répertoire génétique, ce qui confère à la cellule un fort avantage sélectif pour bloquer l’infection. Le but de cet axe de recherche est de déterminer les mécanismes par lesquels la machinerie autophagique est impliquée dans l’entrée des agents pathogènes dans leurs cellules cibles. Nos travaux ont, notamment, montré que l’atg8ylation favorise l’entrée du VIH-1 par fusion membranaire dans les lymphocytes T CD4+, et ce indépendamment de l’autophagie. Nous recherchons si ce processus est commun à l’entrée d’autres virus enveloppés, notamment le SARS-CoV-2. Nous recherchons également le rôle de l’autophagie et de l’atg8ylation dans les étapes précoces de l’infection des macrophages par différentes espèces de Nocardia, pour lesquelles rien n’est actuellement connu.
2. Rôle de l’autophagie et de l’atg8ylation dans la multiplication des agents pathogènes et dans le maintien de l’homéostasie cellulaire
La voie de l’autophagie est bien connue pour contrôler les infections et maintenir l’homéostasie cellulaire. Les agents pathogènes exploitent ou neutralisent ces mécanismes pour assurer leur réplication en impactant potentiellement la survie des cellules infectées. Dans ce contexte, nous étudions plus particulièrement le rôle de l’autophagie sur la réponse immunitaire innée déclenchée suite à l’infection par différents virus enveloppés. Le rôle de la machinerie autophagique sur le maintien de l’homéostasie cellulaire au cours des infections est également étudié dans ce contexte. Dans le cas du modèle de la bactérie Nocardia, rien n’est actuellement connu sur ses mécanismes de réplication dans les cellules hôtes. Cependant, le fait que cette bactérie se multiplie efficacement dans ses cellules cibles suggère fortement qu’elle s’est adaptée afin de bloquer ou d’utiliser la machinerie autophagique à son avantage. Nous déterminerons donc, par différentes approches, quels sont les déterminants bactériens permettant à cette bactérie de survivre et de se multiplier en recherchant ses interactions avec la machinerie autophagique.
 L’équipe AMI étudie les interactions entre les agents pathogènes (bactéries et virus) et le mécanisme d’autophagie, notamment l’autophagie canonique et l’Atg8ylation, tout au long du cycle de vie de l’agent pathogène, de son entrée dans les cellules cibles à sa réplication et à son homéostasie cellulaire. Ce projet, qui s’appuie sur des aspects fondamentaux des interactions entre les processus liés à l’autophagie et les agents pathogènes, permettra de mieux comprendre les mécanismes des infections.
L’équipe AMI étudie les interactions entre les agents pathogènes (bactéries et virus) et le mécanisme d’autophagie, notamment l’autophagie canonique et l’Atg8ylation, tout au long du cycle de vie de l’agent pathogène, de son entrée dans les cellules cibles à sa réplication et à son homéostasie cellulaire. Ce projet, qui s’appuie sur des aspects fondamentaux des interactions entre les processus liés à l’autophagie et les agents pathogènes, permettra de mieux comprendre les mécanismes des infections.
3. Identifier les mécanismes de résistance aux traitements de première intention, aux bêtalactamines et aux aminoglycosides chez les espèces de Nocardia.
Les espèces de Nocardia sont considérées comme des agents pathogènes émergents, car le nombre d’infections devrait augmenter dans les années à venir et parallèlement à celui des affections chroniques, telles que la bronchopneumopathie chronique obstructive. La nocardiose est prise en charge par un traitement de première intention composé de deux molécules, le triméthoprime et le sulfaméthoxazole et ciblant respectivement la dihydrofolate réductase et la dihydroptéroate synthase. Ces deux enzymes sont impliquées dans la synthèse d’une vitamine essentielle, l’acide folique. Le traitement étant long, le risque de résistance aux antimicrobiens est augmenté. En clinique, des résistances au traitement de première intention est souvent observé. Pour les infections sévères de nocardiose ou en cas d’échec du traitement, d’autres classes d’antibiotiques telles que les bêta-lactamines (dérivés de pénicilline) et/ou les aminosides peuvent être associées. Une résistance à ces deux classes d’antibiotiques a toutefois été rapportée chez certaines espèces de Nocardia, mais les mécanismes ne sont pas bien connus. Comprendre cette résistance aux antibiotiques et notamment à l’échelle moléculaire pourrait donc aider à mieux combattre les infections à Nocardia. Pour répondre à ces questions, nous employons des approches relatives aux techniques biochimiques, structurales et microbiologiques.
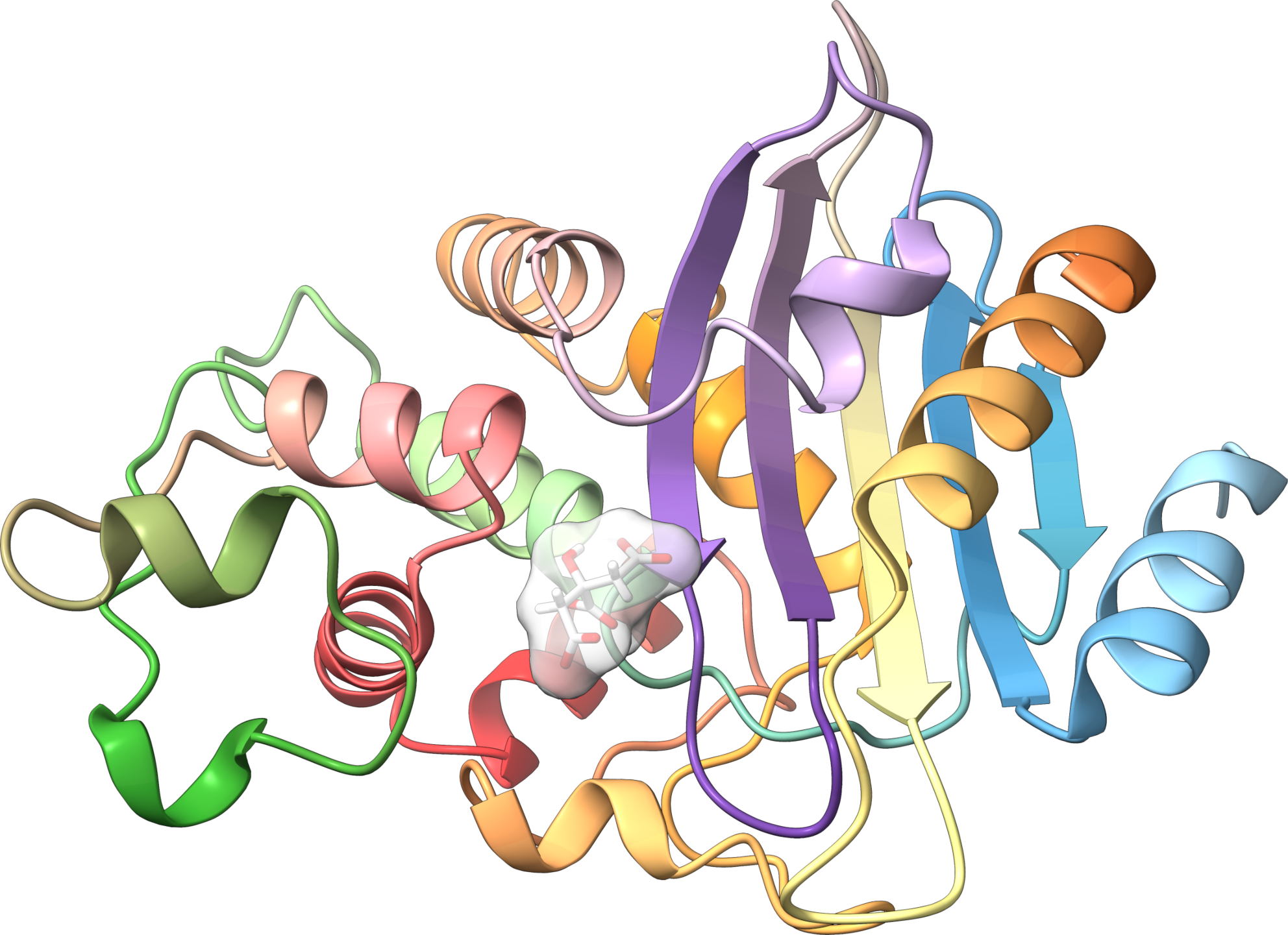
Structure aux rayons-X d’une bêta-lactamase de classe A de N. cyriciacigeorgica conférant la résistance aux dérivés de pénicilline
Mots clés : Autophagie – Atg8ylation – Virus enveloppés – Nocardia spp – Antibiorésistance – Biologie structurale








