nucleotidases
1) Développement d’inhibiteurs contre la nucléotidase 5’-cytosolique- II (cN-II)
Cette enzyme appartient à la superfamille des HaloAcid déhalogénase (HAD) et sa fonction est de réguler le pool intracellulaire de nucléotides. Elle catalyse la réaction d’hydrolyse des nucléotides 5′-monophosphate (préférentiellement IMP, AMP et GMP) et les convertit en nucléoside correspondant et libère du phosphate inorganique (voir ci-dessous).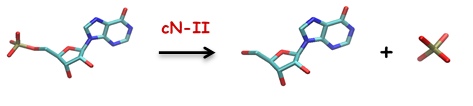
– Assemblage de plusieurs fragments (« Fragment-Based Drug Design » ou FBDD)
– Synthèse d’analogues du substrat (nucléotide b-hydroxy-phosphonate)
– Identification de nouveaux candidats par criblage virtuel
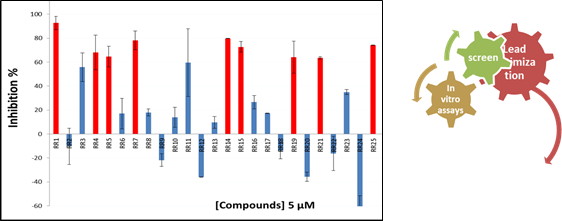
Stratégie “FBDD”: criblage expérimental d’une librairie de 1200 petits fragments et assemblage de trois fragments ayant été identifiés comme se fixant sur cN-II. L’approche par liaison de fragments est guidée par modélisation et ancrage moléculaire (sélection de fragments non chevauchants dans le site de fixation) puis suivie de la synthèse chimique des composés.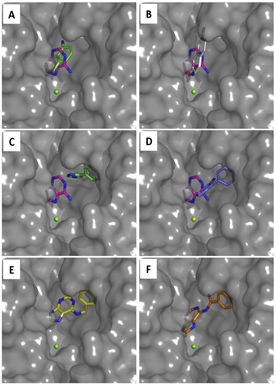
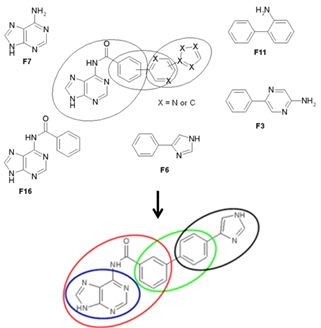
Marton Z. et al. “Identification of non-competitive inhibitors of cytosolic 5′-nucleotidase II using a fragment-based approach.” J. Med Chem. (2015) 58, 9680-96. Pubmed
2) Développement d’inhibiteurs sélectifs de CD73 pour rétablir la réponse immunitaire anticancéreuse.
CD73 ou 5’-ectonucléotidase est le seul membre extracellulaire de cette famille, reliée à la surface membranaire par une ancre glycolipidique (GPI). CD73 est devenu depuis quelques années une cible thérapeutique majeure en immuno-oncologie étant donné que cette enzyme est surexprimée sur les cellules tumorales et les lymphocytes Teff. Sa fonction est de réguler l’AMP extracellulaire et catalyse la réaction d’hydrolyse de l’AMP en adénosine (ADO). L’inconvénient majeur est que l’ADO est un puissant immunosuppresseur favorisant le développement tumoral en bloquant nos défenses immunitaires.
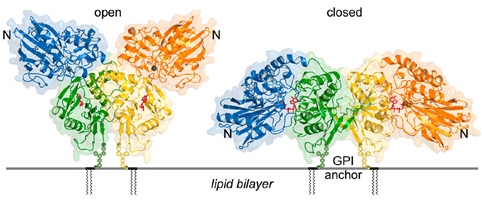
Adapté de Knapp et al., Cell (2012)
Une approche originale a été développée pour découvrir de nouveaux inhibiteurs spécifiques de CD73. Cette approche implique en premier lieu des simulations de dynamique moléculaire afin de reproduire les mouvements de grande amplitude des domaines N-terminaux qui conduisent à une conformation fermée de l’enzyme et ainsi la formation des sites actifs. La stratégie ici, a été de cribler in silico sur plusieurs conformations des chimiothèques de petites molécules capables de venir s’insérer dans l’interface de dimérisation afin bloquer cette dynamique et par conséquent sa fonction.
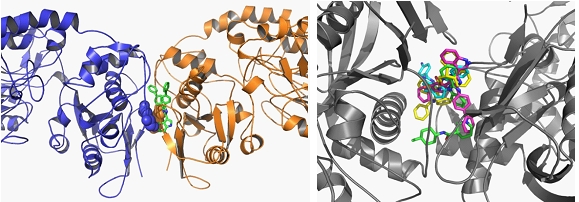
a) Sélection d’une cavité “druggable” présentant des variations de volume au cours des simulations de dynamique moléculaire (bleu)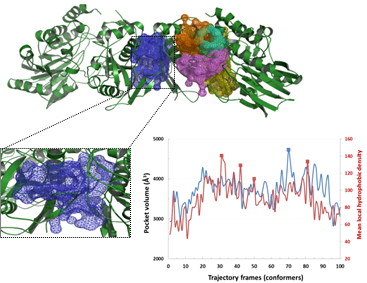

b) Evaluation in vitro des potentiels inhibiteurs de CD73 (cinétiques d’inhibition) suivie de la phase d’optimisation des chefs de files par des méthodes chémoinformatiques